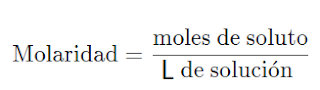Bitácora del Inge
Saludos colegas, espero se encuentren de la mejor forma, aunque sea la forma resultante de comer tanto y de estar encerrados 😂😂😂
Recuerden seguir este BLOG y dejarle muchos comentarios para que sigamos creciendo en conocimiento, justamente como dice mi buen amigo el Profe Nachito Guadarrama de la ENCB
"Conocimiento que no es compartido, no sirve"
En vísperas del regreso a clases presenciales y en total desesperación de regresar a la normalidad, es de mi agrado postearles esto, aunque es evidente que el mundo como lo conocimos hasta el 2019 va a tardar en regresar si no es que ya no regresa, y no es del todo malo, mis mejores deseos este año que comienza, que todos sus proyectos vean la luz, inicienlos, es lo mas difícil ya después vemos como mantenerlos en marcha, total que podemos perder. Pues venga este 2022
Mencion especial para mi profesora M en C Maria Guadalupe Cardona Hinojosa, aprovecho este espacio para hacer un humilde reconocimiento a la trayectoria de tan ilustre Profesora, años y años de enseñar, no solo la importancia de la Calidad en la industria farmacéutica, sino la importancia de ser personas de calidad, nos decia:
"La calidad nace, no se hace".
Si la calidad nace no se hace, no importa quien gobierne el país si su materia prima (Nos señala a todos) es de mala calidad
Muchas lecciones de vida nos deja la profesora, por lo menos a los que la conocimos y tratamos todos sus HARAGANES la vamos a extrañar, un abrazo en donde quiera que se encuentre
RECOMENDACIÓN DEL MES
En linea con lo que es la contingencia mi recomedación será para una serie de podcast de Spotify
Si aun no lo escuchan dense la oportunidad, les aseguro que no se van a arrepentir, viajes en el tiempo, decadencia de la humanidad, fe, y decisiones dificiles entre lo individual y lo colectivo, no quisiera decirles mucho solo que se den el chance de escuchar el primer capitulo de la primer temporada, seguramente los atrapara tal como a mi, aquí les dejo el enlace al primer capítulo
https://open.spotify.com/episode/5ExCQmTZaVAXkXcTE31NUY?si=sFt_4FQXQn-TGG-AB3YhLw&utm_source=copy-link
Si son nuevos por acá, los invito a que me sigan en twitter
@especialistain1
Tambien a que sigan este BLOG
Como saben la intención de este espacio es para apoyarnos en el trabajo diario del Químico, normalmente nos enfocamos en el diagnóstico y reparacion de los equipos e instrumentos que utilizamos en el laboratorio, como cuando el potenciómetro no cumple la verificación, o la balanza no estabiliza, o el HPLC se presuriza o el Disolutor no calienta o no toma la muestra, o el Croma de Gases no muestra señal o no comunica con el Head Space, etcétera, etcétera, etcétera, lo que me gustaria abordar esta vez es el cálculo de concentraciones y la preparación de soluciones, algo aparentemente básico pero que en realidad tiene sus complicaciones. Existen muchas formas de expresar las concentraciones de una solución pero solo nos enfocaremos en Molaridad, Normalidad, Normalidad, ppm, ppb y porcentaje (m/v, m/m, v/v). Si tienes alguna duda más al respecto puedes escribirme @especialistain1, especialistaindependiente22@gmail.com, o en los comentarios de este BLOG
La aplicación de conceptos es fundamental en este tema, es por eso que lo primero que se tendria que definir es el concepto de solución
Una solución se define como una mezcla homogénea de dos o más sustancias químicas puras, puede ocurrir a nivel molecular o iónico y no constituye una reacción química y estas pueden ser diluida, concentrada, saturada o sobresaturada como se muestra en la imagen, los términos en los que describimos estas disoluciones es a lo que llamamos MOLARIDAD, MOLALIDAD, NORMALIDAD, etc.
Debemos tener criterio con la aplicación de estos conceptos dado que entre más lo apliquemos, más lo ejercitemos, encontraremos nuevas formas de aplicarlo, es por eso que para poder quitarnos esa laguna de información con respecto al cálculo de concentraciones debemos hacer varios ejercicios
MOLARIDAD
Por definición es:
Pero,¿qué implica el concepto?
- Siempre que se calcule molaridad tendremos en mente que se trata de una cantidad de moles en un litro de solución
- Los moles de soluto se refieren a lo que se esta disolviendo, a veces se expresa en gramos (g), mililitros (mL), equivalentes (eq), etc, pero para que se llame MOLARIDAD esta cantidad de soluto a disolver debe expresarse en MOLES
MOLES
El mol en realidad es una maravilla de concepto fisicoquímico, se refiere a la descripción de cantidad de materia de tal forma que nos ayude a simplificar cálculos y representaciones de las reacciones químicas, veamos esto
NaCl >>>> Na = 22.9897 g Cl = 35.453g >>>>> 58.4427 g
La masa atómica del Na = 22.9897g, del Cl = 35.453 g y la de la molecula de NaCl = 58.4427g
Imaginen que al momento de realizar los calculos estequiométricos para la formación de esta sal se tengan que utilizar las unidades que conocemos para masa, nos costaría trabajo seguirle el paso a toda la transformación de la materia durante una reacción química, es ahí, donde surge el concepto de mol
NaCl >>Na = 1 mol(22.9897g) ; Cl = 1 mol (35.453g)>>NaCl 1 mol (58.4427g)
y si se dan cuenta la relación en la que se mezclaron fue 1 mol de Na >>> 1 mol de Cl >>> nos da 1 mol de NaCl
¿Que pasa entonces si necesitamos una solución 2M de NaCl?
Sabemos que 1 mol de NaCl = 58.4427g NaCl
Entonces 2 mol de NaCl = 116.8854g NaCl
Es decir, que nosotros tenemos que pesar en la balanza 116.8854g de NaCl para que se considere que tenemos la cantidad suficiente para representar 2 mol de NaCl
Ahora el concepto de MOLARIDAD nos dice
Ya conocemos la cantidad de soluto a medir que es necesaria para obtener una solución MOLAR, 2M
Como lo dice la definición, son moles por Litro de solución (L) en este caso tendriamos que disolver los 116.8854g NaCl en 1 Litro de disolvente para obtener una solucion 2M de NaCl, así de sencillo, aplicando concepto, este cálculo te puede servir de base para todos los que requieras de concentración Molar, lo "complicado" viene cuando tienes que preparar menos de un Litro, considerar la pureza, o cosas por el estilo, pero si te quedas te lo explico con gusto
Tienes dudas?, escribeme especialistaindependiente22@gmail.com, @especialistain1
Dicen que para aprender a nadar, se tiene que nadar, o sea, a nadar se aprende nadando, y en este caso a calcular se aprende calculando y solo para que no se queden con la duda, les dejo algunos ejercicios, manden sus resultados a @especialistain1
MOL
Cuantos moles tiene
177.812 g de ITRIO
120.234 g de CALCIO
22.990 g de SODIO
154.87 g de FÓSFORO
799.04 g de BROMO
Cuantos g tiene
1 mol de Hidrógeno
2 mol de Oxígeno
3 mol Telurio
4 mol de Cobre
5 mol de Níquel
Apliquemos el concepto de MOLARIDAD
1.- Prepare una solucion de NaCl 3.4M
2.- Prepare una solución de KCl 5M
3.- Prepare una solución de H2O 4M
4.- Prepare una solución de MgCl2 2M
5.- Prepare una solución de CaCl2 1M
Este concepto como les decia entre más lo uses mas aplicaciones le van a encontrar por ejemplo, en la mayoria de los casos son sólidos que se van a disolver en un líquido, pero ¿que pasa cuando la forma física del soluto es líquida ?como por ejemplo el HCl
Preparemos una solución 3M de HCl
Sabemos que el volumen final será 1L, para que corresponda con el concepto de Molaridad
Calculemos molaridad
H = 1.008 g
Cl = 35.45 g >>>>>> HCl = 36.458 g >>>> 1 mol de HCl
Interpretemos
1 mol de HCl debe contener 36.458g de HCl
Sabemos que la forma físca del HCl es líquida, por lo tanto nos apoyamos en su valor de densidad
Densidad de HCl = 1.15 g/mL (este valor puede cambiar según la fuente que consultes)
Hagamos la relacion, sabemos que la densidad esta definida como una relacion entre masa y volumen, de ahí despejamos el valor del volumen
D = m/V >>>>> V * D = m >>>>> V = m/D >>>>> 36.458 [g] / 1.15 [g/mL]
V = 31.7026 mL es el volumen de HCl correspondiente a 1 mol de HCl
Si te ayuda, debemos verlo así
36.458 g = 31.7026 mL = 1 mol
de tal forma que si necesitamos 3M de HCl tendriamos que multiplicar este valor por 3
31.7026 mL * 3 = 95.1078 mL de HCl corresponden a 3 M, es decir, tienes que disolver 95.1078 mL en 1 L de agua y con esto tendrias una solución 3M de HCl, en teoria
Como se aplica la pureza al calculo, la pureza del HCl la vas a encontrar en el frasco del reactivo como Ensayo (Assay) o pureza como tal o bien reportado en las tablas MSDS referentes a la seguridad en el manejo del reactivo, la pureza reportada para el HCl es de 37%
Por concepto nos dice que de cada 100 partes contenidas en el frasco 37 son de HCl
Nosotros necesitamos 95.1078 mL de HCl, esto es
95.1078 mL de HCl >>>>>>>>> 37%
X=257.0481 mL de HCl
La secuencia de razonamiento es: si necesitamos 95.1078 mL de HCl y sabemos que solo el 37% es puro, se realiza una regla de 3, esperamos que sea un valor mayor el que se tenga que medir para alcanzar la cantidad deseada
El final de la preparación de esta solución es medir estos 257 mL, colocarlos en un matraz aforado de 1L y completar el volumen hasta el aforo, con esto tendriamos 109.374 g = 95.1078 mL = 3 mol de HCl lo que nos da la aplicación del concepto de Molaridad; M = mol/Litro
 Ya solo nos falta revisar cuando nos piden una cantidad especifica de solución, es decir, 100 mL, 250 mL o 730 mL
Ya solo nos falta revisar cuando nos piden una cantidad especifica de solución, es decir, 100 mL, 250 mL o 730 mLRetomemos el ejemplo
Sabemos que para preparar 1 L de solucion 3M de HCl se necesitan 257.0481 mL de HCl, esta la podemos tomar como nuestra referencia ya que ya esta afectada por la pureza y por la densidad, nos quedaría como sigue
1L de HCl 3M requieren 257.0481 mL de HCl comercial
Supongamos que necesitamos preparar 250 mL (0.25 L)
Entonces quedaria la regla de 3
1L de HCl 3M requieren 257.0481 mL de HCl comercial
0.25 L de HCl 3M requieren = 64.2620 mL de HCl comercial
Hay varias formas de calcular estas cantidades es por eso que se debe practicar bastante para crear el criterio y la forma que mas te acomode para realizar estos cálculos
Hagamos ejercicio
1.- Se requiere una solucion 3M de HCl
2.- Se requiere una solucion 6M de NaOH
3.- Se requiere una solución 2M de H2SO4
4.- Se requiere una solución 5M de NH4OH
5.- Preparar 100 mL de una solucion 4M de HCl
6.- Preparar 250 mL de una solucion 0.5M de NaOH
7.- Preparar 300 mL de una solucion 0.7M de HNO3
8.- Preparar 470 mL de una solución 7M de Ca(OH)2
9.- Preparar 1.5L de una solucion 2M de H2SO4
10.- Preparar 2L de una solucion 0.5M de NH4OH
Para MOLARIDAD seria todo por el momento, por supuesto que si buscas en la red vas a encontrar muchas formas diferentes de hacer estos calculos, pero ten en cuenta que todos parten del mismo fundamento y mientras los sigas, tu mismo encontrarás una forma distinta de llegar a un buen resultado
Te espero en la siguiente entrega que será sobre MOLALIDAD
Recuerda seguir este BLOG y la cuenta de twitter @especialistain1
Si me equivoque en algun cálculo o peor aún en algun razonamiento, por favor ponlo en los cometarios que a fin de cuentas nadie es infalible
Saludos, cuidense mucho y Feliz 2022